临床试验的角色与阶段划分
新药临床试验一般分为 I期、II期、III期(以及上市后IV期)等阶段,每一阶段有不同的目标和规模,对应的成本差异显著:
I期临床试验:通常在20~100名受试者(常为健康志愿者或晚期患者)中进行,主要评估新药的安全性和剂量范围。规模较小、持续数月至1-2年,是成本最低的阶段,但仍需投入数百万美元级别资金。一般I期试验的平均费用约为0.4亿美元(约400万美元)左右。
II期临床试验:在约100~500名相关疾病患者中进行,初步考察新药的有效性及安全性。规模和持续时间增加(数月至2年),需要更多患者观察和更复杂的数据分析,因此成本显著上升,通常达到数千万人民币规模。各治疗领域II期试验费用中位数在0.7亿~2.0亿美元不等(约数千万美元),例如一项研究估计肿瘤领域II期试验平均成本约为1.1亿美元。
III期临床试验:在数百至上千名患者中进行的大规模试验,用于确证新药的有效性和安全性,并与标准疗法对比。III期试验涉及众多研究中心、长期随访和庞大的数据收集,是研发过程中最昂贵的阶段。其费用通常达到2亿~10亿美元量级不等。例如,美国卫生与公共服务部的一项报告指出,肿瘤领域单项III期临床试验平均花费约2,200万美元,但常见癌症的III期项目若涉及数千患者和长期随访,费用可轻易超过5,000万-1亿美元。
IV期临床试验(上市后研究):在新药获得监管批准上市后进行,用于监测长期安全性和有效性,或拓展新的适应证。IV期试验规模和形式差异很大,可能是数百人的观察性研究或更广泛的人群随访。因此成本范围波动较大,大致从数十万美元到数千万美元不等。一般来说,IV期试验单项研究平均花费可在数百万美元级别,但若为大型上市后安全性项目,投入也可能达到与III期相当的量级。
临床试验成本构成
临床试验的总成本由多种要素构成,各部分费用之和决定了试验的整体开支。据统计分析,临床程序实施和检测、人员劳务、以及现场监查等是占比最高的成本类别,三者常合计超过总费用的40%。具体而言,主要成本构成包括:
患者招募:寻找并招募符合试验标准的受试者往往耗费大量时间和资金。包括招募广告、招募机构费用以及对受试者的补偿等。每纳入一位患者的招募成本可高达数万美元,针对罕见病或特定人群时更为昂贵(每位患者约需15,000~50,000美元)。此外,为减少患者中途退出,提高患者保持率(如提供交通补贴等)也会增加额外开支。
研究中心运营:指各临床试验中心开展研究的日常运营费用,包括研究者和工作人员的薪酬、培训,场地和设备使用,机构管理费,以及试验相关的行政支持等。人员成本是临床试验最大的一块支出:例如在美国,主要研究者和临床协调员的人力薪酬水平处于全球最高行列。一项针对III期试验的分析显示,行政人员和研究人员薪酬约占总成本的20%,是单项比例最高的成本构成。同时,多中心试验需支付给各参与医院/机构的现场管理费和现场监查费,这在美国比东欧或亚洲高出30~50%。例如,一个典型大型III期试验的现场监查费用可占总成本约10–15%。
药品制造与配送:为临床试验专门生产、包装实验药物(包括对照药或安慰剂)并将其配送到各试验中心的费用。在符合FDA等监管要求下生产研究药物本身成本不菲,特别是一些生物制品或需冷链运输的产品。在随机对照试验中,安慰剂的制造成本有时与实验药物相当。此外,将药物按方案要求配送到全球各地中心,以及回收未用药品、药物合规存储等也都计入成本。
数据管理:指试验过程中数据的采集、存储和分析相关费用。包括临床数据管理系统(如电子数据采集EDC)的搭建和维护、病例报告表设计、数据库维护、统计分析和报告撰写等。为了确保数据质量,需要投入专业人员和IT系统。当前临床试验常采用电子化数据采集和远程数据传输,这虽然提高了效率,但前期部署也需投入可观成本。例如,为一项I期试验开发和运行EDC系统、执行数据核查清理,其数据管理费用可能就达到数万美元。
监管合规:确保试验符合监管机构要求所产生的费用,包括伦理委员会(IRB)审批费、试验注册备案、向FDA/EMA提交申请和报告的费用,以及为应对监管检查所做的准备等。这部分开支虽然相对试验直接实施费用较小,但必不可少。例如,准备一份完整的新药临床试验申请(IND)或新药上市申请(NDA/BLA)往往需要耗费大量人力撰写成千上万页的技术资料,费用可能数百万美元。在试验过程中,为遵循GCP(良好临床规范)、患者隐私保护(如HIPAA)等要求而进行的培训、监查和质量控制也属于合规成本。此外,任何方案修正(protocol amendment)都需再次审批和实施,也会带来额外费用——据统计,每次重大方案修订可使II期和III期试验分别增加约14.1万和53.5万美元支出。
以上各项成本因试验具体情况而异。总体而言,在一项典型的III期临床试验中,人力与管理费用、患者相关费用(招募和检查)、以及监查费用构成主要部分。例如,有研究估算临床程序和检测约占总成本的15–22%、行政人员11–29%、现场监查约9–14%。因此,控制这些关键环节的开支对降低总体成本至关重要。
临床试验成本的影响因素
临床试验的成本受到多方面因素影响,不同试验项目间的费用差异往往可归因于以下几个关键因素:
试验规模(入组受试者和中心数量):试验纳入的患者人数和参与的研究中心数量对成本有直接影响。规模越大,所需的药物数量、数据收集和人员投入也越多,成本随之上升。例如,小型I期试验可能只需要一个中心几十名志愿者,而大型III期国际多中心试验可能涉及成百上千患者、数十个中心,开支呈数量级增长。在III期,大规模患者招募和多中心管理被视为推高成本的主要驱动因素。因此,药企在设计试验时会权衡样本量的统计要求与可承受的成本之间的平衡。
疾病类型(治疗领域):不同疾病领域临床试验的平均成本差异显著。一些疾病(如心血管、皮肤病)的试验可能相对简便,而另一些领域(如肿瘤、罕见病、免疫疾病)往往需要更复杂的试验方案和特殊检测,费用更高。有研究比较了各治疗领域单个试验的花费:I期试验平均成本从140万美元(镇痛领域)到660万美元(免疫调节领域)不等;II期从700万美元(心血管)到1,960万美元(血液病);III期则从1,150万美元(皮肤病)一路攀升至5,290万美元(镇痛领域)。由此可见,不同适应症的试验在所需患者人数、观察终点、随访时间以及所需的诊断检测方面差异很大,进而导致成本高低不同。一般而言,肿瘤和罕见疾病领域的试验单位患者成本更高,因为这些试验往往需要高级别的成像、生物标志物检测,以及更难招募的患者群体。
试验地理范围(地区差异):临床试验在不同国家或地区开展,成本会有明显差异。在美国等发达国家,由于人力、设施和管理费用昂贵,同样规模的试验成本往往高于在新兴国家进行。调查显示,在印度开展临床试验平均比美国节省约44%的费用(美国约1.25亿美元 vs 印度约7,000万美元)。这促使许多制药公司将部分临床研究外包到成本较低的地区,如东欧、亚洲和拉丁美洲。需要注意的是,多地区试验虽然节省单位成本,但管理复杂性增加(例如多国监管审批、物流和文化差异),这些因素本身也会增加一些运营成本。
纳入标准复杂性:试验的受试者筛选标准和方案复杂程度也显著影响成本。如果试验的纳入/排除标准非常严格,为找到符合条件的患者往往需要筛选大量候选者,筛选失败率高会抬升每位实际入组患者的获募成本。有统计表明,近十年间临床试验的复杂度大幅增加:2000年代初约有52%的筛选患者最终能够入组试验,而到2006年这一比例降至28%。这意味着研究者必须筛选更多患者才能达到目标样本量,招募投入随之提高。另外,方案设计复杂度的提升(例如疗效终点和数据采集点数量的增加)也推高了成本。一项覆盖9,737份临床试验方案的研究发现,每个方案的平均终点数量在2001–2005与2011–2015年间增加了86%。更多的观察终点和评估意味着更多的检测、随访和数据处理工作,对应增加人员和设备开销。由此可见,尽管严谨的试验设计有助于获得更可靠的数据,但也会不可避免地带来成本上的上升。
上述因素经常交互作用,共同决定了一项试验的总体成本。举例而言,在一个针对罕见疾病的全球III期试验中,小患者人群、高复杂度方案、多国多中心的特点可能同时存在,使得单位患者费用极高。而一项针对常见疾病的本地II期试验,若设计合理、患者易招募,则可以相对节省。制药企业在规划试验时,会综合考虑这些因素,通过试验设计优化和项目管理来控制成本。
近年来临床试验成本的变化趋势
过去十余年间,新药临床试验成本总体呈现不断攀升的趋势。20世纪末至21世纪初,一些权威研究已经注意到研发成本的迅猛增长。Tufts药物研发中心的一项著名研究指出,从2003年到2013年,成功开发一种新药(包括临床试验在内)的平均费用从约8.02亿美元跃升至25.58亿美元,十年间上涨了145%。这一数字如果考虑通货膨胀,在2020年代相当于超过33亿美元的投入。进入2010年代中后期后,单一新药项目的平均研发成本依然处于高位。Deloitte的最新分析显示,2022年顶尖药企每个新药项目平均研发成本约22.84亿美元,虽略低于2013年的历史峰值,但仍与峰值相当。同时,约翰霍普金斯大学等研究团队对FDA近年审批的新药临床试验费用分析发现,支持新药上市的关键临床试验中位成本约为1.9亿美元。这些数据表明,临床试验相关的研发投入在近十年并未减少,而是维持在高昂水平甚至继续上升。
导致临床试验成本居高不下并不断上涨的原因是多方面的。首先,试验复杂性持续增加,正如前文提及的方案终点和数据量的激增,需要投入更多资源来执行和管理。复杂方案往往导致执行效率降低:例如受试者招募变难、试验周期拉长等,从而推高总成本。实际数据也印证了这一点——III期临床试验的平均持续时间已从2010年的约2.3年延长到2021年的约3.3年。更长的试验周期意味着研究团队、中心设施和随访管理等方面的开销随时间累积而增加。其次,人力和运营成本的上升也是重要因素。药物研发是一项高度专业化的工作,医护人员、研究人员的薪酬水平近年来稳步上涨,加之通货膨胀的影响,使得试验各环节单价成本提高。再次,监管要求趋严和数据质量标准提高也在一定程度上推高成本。如今的试验需要更加详尽的安全监测、更严格的合规审查和更加全面的数据收集,这些附加要求需要投入额外的人力物力去满足。尤其是对于涉及基因疗法等新兴领域的试验,监管部门通常要求开展额外的安全性研究和长期随访,使得研发企业付出更多费用。
此外,研发领域的变化也带来了成本趋势上的影响。医药行业近年来从开发“大众疾病”的重磅药物,逐渐转向攻克小众疾病或个性化疗法(“nichebuster”药物),这类项目的目标患者少且试验设计更具针对性。虽然针对小范围患者的试验规模可能较小,但通常需要特殊的试验条件和高成本的检测手段(如基因测序、细胞治疗生产等),导致平均单人成本攀升。再者,小样本的试验往往要求全球多中心合作来找到足够患者,又叠加了地理因素的成本。本质上,高研发投入与低成功率并存——尤其在肿瘤等领域,大量候选药物在临床阶段失败,失败项目的投入也计入整体研发成本,使得成功产品背后的平均成本进一步走高。
面临不断上涨的试验成本,业界和监管机构也在积极寻求解决之道。临床试验创新设计(如自适应试验、虚拟对照组)和新技术应用被寄予厚望。例如,去中心化临床试验(Decentralized Trials)的理念近年兴起,通过远程监测、居家访视等方式减少对实体中心的依赖,有望降低部分运营开支并加快入组。新冠疫情期间行业被迫采用远程随访、电子患者报告等手段,反而推动了这些降本增效措施的试点,为今后更高效的试验模式铺平道路。同时,制药公司也在加强项目管理,严格控制不必要的程序和数据收集,尽量减少方案修订次数,以避免预算超支。监管层面,FDA和EMA等机构也发布指导,提倡利用真实世界证据、简化试验要求等方式,加速研发且不降低安全标准。这些努力在一定程度上缓解了成本压力。然而,从总体趋势看,临床试验成本仍然受到客观因素制约而居高不下。如何在保障试验质量与有效性的同时控制开支,仍将是未来新药研发领域的一大挑战。
图表展示
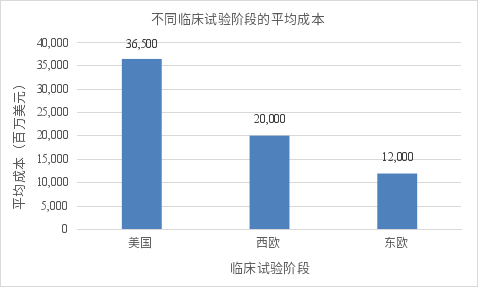
图1:不同临床试验阶段的平均成本(单位:百万美元)。此柱状图比较了新药研发中I、II、III期临床试验的平均费用范围。可以看出,试验成本随阶段大幅攀升:I期通常仅需数百万美元,而III期往往高达数千万甚至上亿美元级别。例如,据美国卫生与公共服务部委托的一项研究,不同治疗领域的I期、II期和III期临床试验每项研究平均成本约为0.4亿、1.3亿和2.0亿美元(约合4百万、1,300万和2,000万美元)。III期费用远高于早期阶段,反映出大规模患者入组、长期随访以及综合数据分析带来的开销累积。值得注意的是,在某些大型项目中,III期试验的投入甚至可超过这一平均范围(高达十亿美元级别),成为新药研发中最昂贵的部分。

图2:全球不同地区临床试验单位成本(每位受试者的平均花费)比较。图中显示了在美国、西欧、东欧、亚太和拉丁美洲进行临床试验的人均成本差异。可以看到,美国临床试验的单位患者成本最高,平均每位受试者约耗资36,500美元。西欧等发达地区次之,每例患者费用大致在1.5万~2.5万美元之间。相比之下,东欧、亚洲、拉美等新兴地区的试验成本明显更低,通常仅为美国的一半左右。例如,亚洲的临床试验成本平均比西方国家低25%~40%;又据调查,在印度开展试验可比美国节省约44%的费用。造成这些地域差异的原因在于各地区的人力和运营成本差异(如研究者薪酬在美国最高,东欧和亚洲较低),以及患者获取难易程度和监管要求不同等因素。例如,美国试验中心经验丰富但费用昂贵,而一些新兴国家患者资源丰富且成本较低,但需要克服监管和基础设施方面的挑战。综上,药企在全球布局临床试验时,会综合考虑成本与质量之间的平衡,在保障数据可靠性的前提下选择有成本优势的地区开展研究。
参考文献:
Tufts Center for the Study of Drug Development (CSDD), “Cost to Develop and Win Marketing Approval for a New Drug Is $2.6 Billion”, Applied Clinical Trials, 2014.
Aylin Sertkaya et al., “Examination of Clinical Trial Costs and Barriers for Drug Development”, Report for US Dept. of Health and Human Services, July 2014.
Moore TJ. et al., “Estimated Costs of Pivotal Clinical Trials for Novel Therapeutic Agents Approved by the US FDA (2015-2016)”, JAMA Intern Med. 2018;178(11):1451-1457.
Frost & Sullivan, “Asia: Preferred Destination for Clinical Trials” (White paper), 2016.
Cutting Edge Information, “Streamlining Clinical Trials”, 2008 – via BioprocessOnline.
Sofpromed CRO, “How Much Does a Clinical Trial Cost?”, 2020.
Sofpromed CRO, “The Ultimate Guide to Clinical Trial Costs in 2025”, 2023.
Antidote Technologies, “How Protocol Complexity is Impacting Patient Recruitment”, 2018.
GEN Edge (Genetic Engineering & Biotechnology News), “The Unbearable Cost of Drug Development”, 2023.
OncoDaily, “How Much Does it Cost to Approve a Drug? EMA vs. FDA”, 2023.上传发帖按钮
 扫码加好友,拉您进群
扫码加好友,拉您进群



 收藏
收藏