Fimepinostat(CUDC-907,AbMole,M2111)是一种具有双重抑制活性的小分子药物,它能同时作用于组蛋白去乙酰化酶(HDACs)和磷脂酰肌醇3激酶(PI3K)。这种独特的分子设计使CUDC-907在肿瘤研究领域中成为了一个重要的工具分子。
AbMole是一家全球领先的科研试剂供应商,提供包括抑制剂、细胞因子、人源单克隆抗体、天然产物、荧光染料、多肽、化合物库和抗生素在内的多种高纯度、高生物活性产品,被广泛应用于科学研究,并在全球范围内有大量的文献和专利引用。
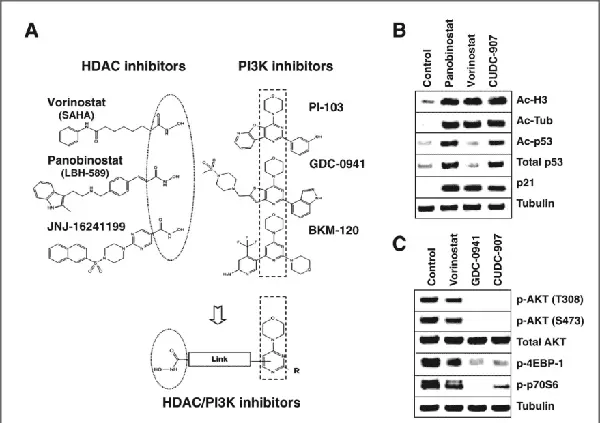
图1. CUDC-907的设计及其对PI3K和HDAC的抑制效果[1]。
CUDC-907(Fimepinostat)的作用机理
PI3K/Akt/mTOR和HDAC信号通路在多个生物学过程中存在交联。PI3K/Akt/mTOR通路是细胞内重要的代谢调节者,调控细胞生长、增殖和生存的关键步骤;而HDAC通过改变组蛋白的乙酰化状态来影响染色质结构和基因表达。同时抑制这两个通路可以产生协同效应。CUDC-907的分子结构包含两个关键的活性区域,分别针对HDACs和PI3K,并通过一个“连接基团”连接形成一个双功能抑制分子。CUDC-907的HDAC结合区由羟肟酸基团组成,这是HDAC抑制剂的常见结构,能够与HDAC活性位点的锌离子形成配位键,从而抑制HDAC的活性;CUDC-907的PI3K结合区含有嘧啶并咪唑环骨架,可以插入PI3K的ATP结合口袋,通过氢键和疏水相互作用阻止PI3K与ATP的结合,抑制PI3K的催化功能;CUDC-907的连接基团是一种灵活的亚甲基链,其长度和构象的灵活性可以防止两个活性区域之间的相互干扰,使得CUDC-907能够同时与HDACs和PI3K形成稳定的复合物,实现协同抑制效果。对于PI3K信号通路,CUDC-907对I类PI3K亚型显示出强烈的抑制作用,对PI3Kα的半数抑制浓度(IC50)仅为19 nM,对PI3Kβ、PI3Kδ和PI3Kγ的IC50值分别为54 nM、39 nM和311 nM。在HDAC抑制方面,CUDC-907对I类和IIb类HDAC成员具有高度的选择性,对HDAC1、HDAC2、HDAC3和HDAC10的IC50分别为1.7 nM、5.0 nM、1.8 nM和2.8 nM[1]。
CUDC-907(Fimepinostat)的研究应用
CUDC-907(Fimepinostat,AbMole,M2111)主要应用于肿瘤抑制研究,例如,在非小细胞肺癌研究中,CUDC-907表现出显著的抗增殖活性。研究数据表明,CUDC-907(Fimepinostat,CAS号: 1339928-25-4)能够以浓度依赖的方式降低A549和H1299细胞的活力,抑制细胞增殖。进一步的机制研究表明,CUDC-907导致A549细胞出现G2/M期细胞周期阻滞,这与周期蛋白A、Cdc25C、Cdc2和周期蛋白B1的表达减少以及p21蛋白水平的增加有关。此外,CUDC-907处理还引发了明显的DNA损伤反应,伴随着有丝分裂的异常。CUDC-907还能诱导H1299细胞发生程序性死亡,表现为Caspase-3、Caspase-8、Caspase-9水平的升高。研究还发现,CUDC-907与PARP抑制剂Olaparib(AZD2281)之间存在较强的协同作用[2],其机制可能涉及CUDC-907对DNA双链断裂修复能力的抑制。在B细胞淋巴瘤研究中,CUDC-907对多种细胞系表现出强烈的抑制活性,对Granta 519、DOHH2、RL、Pfeiffer、SuDHL4、Daudi和Raji细胞的IC50分别为7、1、2、4、3、15和9 nM。在多发性骨髓瘤模型中,CUDC-907对RPMI8226、OPM-2和ARH77细胞的IC50分别为2、1和5 nM,这些数据表明CUDC-907在血液肿瘤研究中具有广泛的活性。在急性髓系白血病(AML)研究中,CUDC-907能够降低AML细胞中FLT3蛋白的水平。因此,CUDC-907可以与FLT3抑制剂Gilteritinib(ASP2215)联合使用,其中CUDC-907能够抵消Gilteritinib引起的FLT3上调,两者协同作用可诱导肿瘤细胞凋亡。在动物模型中,这种联合治疗策略显示出了良好的肿瘤抑制潜力。
在非小细胞肺癌(NSCLC)细胞增殖的影响方面,CUDC-907显示出显著的抑制作用。具体而言,该药物通过诱导有丝分裂灾难和下调YAP/TAZ信号传导来发挥作用。
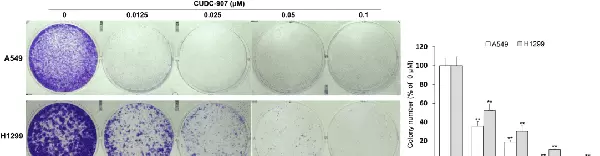
图2展示了CUDC-907对NSCLC细胞增殖的影响。
在胰腺癌研究领域,CUDC-907(商品名Fimepinostat,供应商AbMole,产品编号M2111)通过抑制HDAC6-FOXO1-c-Myc信号轴减少c-Myc蛋白的转录,并通过PI3K抑制作用加速c-Myc蛋白的降解。这一双重作用机制显著降低了c-Myc蛋白水平,从而削弱了胰腺癌细胞的增殖能力。体外实验表明,CUDC-907能够以浓度依赖的方式将胰腺癌细胞停滞在G2/M期,并显著诱导细胞凋亡。此外,在动物模型中,CUDC-907对Aspc-1胰腺癌细胞系构建的皮下移植瘤模型展现了明显的生长抑制效果。
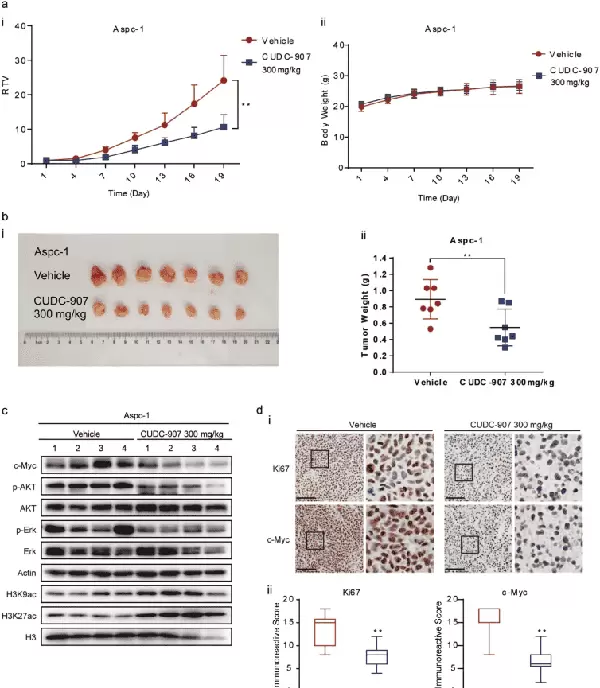
图3显示了CUDC-907在体内抑制胰腺癌生长的效果。
关于肿瘤干细胞(CSCs)的研究揭示,这些细胞的自我更新能力依赖于PI3K/Akt/mTOR途径和表观遗传调控(包括HDACs的作用)。CUDC-907作为双靶点抑制剂,能够有效减弱CSCs的干性特征。例如,在乳腺癌CSCs的研究中,使用CUDC-907处理后,CD44+/CD24-细胞的比例从20%大幅降至5%,并且与干性相关的基因(如SOX2、OCT4)的转录水平也有所下降,这为研究CSCs的调控机制提供了有价值的工具。
在甲状腺癌研究中,CUDC-907不仅抑制了PI3K/AKT信号通路,还影响了EGFR/RAS/RAF/MEK/ERK信号通路。研究表明,CUDC-907在体外能有效抑制甲状腺癌细胞的生长、侵袭和迁移,并且在转移性甲状腺癌的小鼠模型中也能抑制肿瘤的生长和转移。
值得注意的是,AbMole是中国区ChemBridge的官方指定合作伙伴。
参考文献及鸣谢
- Chang, Y.-T., Lin, Y.-C., Sun, L., et al. (2020). Wilforine resensitizes multidrug resistant cancer cells via competitive inhibition of P-glycoprotein. Journal of Experimental & Clinical Cancer Research, 71, 153239.
- Ma, L., Bian, X., Lin, W. (2020). The dual HDAC-PI3K inhibitor CUDC-907 displays single-agent activity and synergizes with PARP inhibitor olaparib in small cell lung cancer. Journal of Experimental & Clinical Cancer Research, 39(1), 219.
- Liu, Y., Qi, X., Luo, X. P., et al. (2025). CUDC-907 exerts an inhibitory effect on non-small cell lung cancer associated with induction of mitotic catastrophe and downregulation of YAP/TAZ signaling. Chemical Biology & Drug Design, 421, 111735.
- Fu, X. H., Zhang, X., Yang, H., et al. (2019). CUDC-907 displays potent antitumor activity against human pancreatic adenocarcinoma in vitro and in vivo through inhibition of HDAC6 to downregulate c-Myc expression. Acta Pharmacologica Sinica, 40(5), 677-688.
- Li, M., Hu, Y., Wang, J., et al. (2023). The dual HDAC and PI3K inhibitor, CUDC-907, inhibits tumor growth and stem-like properties by suppressing PTX3 in neuroblastoma. International Journal of Cancer, 64(2), 14.
由Daniela Tomaselli, Alessia Lucidi, Dante Rotili等人共同撰写的《表观遗传多药理学:药物发现的新前沿》发表于2020年,该文章深入探讨了在药物开发领域中,如何通过表观遗传学途径实现多靶点干预的策略。文章详细分析了当前的研究进展,包括不同类型的表观遗传修饰及其在疾病治疗中的潜在应用,强调了跨学科合作对于推动这一新兴领域的必要性。
文章指出,传统的药物设计通常针对单一目标,而表观遗传多药理学则旨在同时影响多个生物过程,这为复杂疾病的治疗提供了新的思路。作者们还讨论了现有的技术和方法,以及未来研究的方向,提出了表观遗传药物开发面临的挑战和机遇。
该研究不仅为学术界提供了宝贵的参考资料,也为制药行业的创新和发展指明了方向。通过综合运用化学、生物学和医学等多学科的知识和技术,表观遗传多药理学有望成为未来药物研发的重要领域之一。
[6] Tomaselli D, Lucidi A, Rotili D, et al. Epigenetic polypharmacology: a new frontier for epi-drug discovery. Drug Discov Today. 2020;40(1):190-244.

 扫码加好友,拉您进群
扫码加好友,拉您进群