离开匈牙利白手起家,要想成功,必须为我们的生活、我们的生存和我们的成功不懈努力。祝贺她成为2023年诺贝尔生理学或医学奖得主!
撰文 | 郭晓强
原标题:《新晋诺奖得主:中年失业、患癌,她用四十年逆袭拯救全人类,还培养了一个奥运冠军》
2020年12月起,英国、加拿大、美国等国家相继批准了辉瑞制药与德国BioNTech联合开发的新冠mRNA疫苗紧急使用,人们终于看到了结束全球新冠疫情的希望。
与其他疫苗相比,mRNA疫苗具有诸多优点:首先是安全性高,mRNA不具备感染性,也不必整合到基因组,其在体内寿命可根据需要通过体外操作来实现(避免长期滞留带来危害);第二是免疫性好,目前的mRNA疫苗已较为稳定,可在细胞内进行高效表达产生蛋白质,启动高效免疫应答反应;第三,量产迅速,mRNA体外制备技术非常成熟,可根据需要快速、便捷地制备出大量疫苗。
随着全世界的目光聚集在新冠mRNA疫苗上,这项技术背后曾经默默无闻的关键科学家也浮出水面,接受各大媒体的采访。她就是来自匈牙利的女生物化学家卡里科(Katalin Karikó),今年68岁了。

卡里科在宾州家中工作。from STAT
一 没有回头路
1955 年 1 月 17 日,卡里科出生于匈牙利东部小镇小新萨拉什(Kisújszállás)一间烧着木屑炉子的小屋。仔细检查父亲每日屠宰的猪,便是她的科学启蒙课。
1973年,卡里科考入匈牙利名校塞格德大学(University of Szeged),义无反顾地选择了理科。在大学里,她第一次在一场学术报告里听说了信使RNA(mRNA),它携带着DNA中的遗传信息,直接指导蛋白质的合成,承担着“传讯者”的角色。卡里科对这种神奇的分子产生了浓厚的兴趣。1978年,她选择攻读博士学位,重点研究mRNA的应用。
20世纪七十年代,基因工程诞生,不久基因治疗的概念也应运而生,但这些操作均是以DNA为目标,而卡里科却认为mRNA更有前途。毕业后,她选择了进入匈牙利科学院塞格德生物中心(Biological Research Centre, Szeged)生物物理研究所。当时,许多人博士毕业后去美国留学深造,但卡里科对此并不动心,她认为国内同样可以实现自己的愿望。遗憾的是,卡里科这个美好愿望于1985年破灭了,她被单位解雇了。
多年后,卡里科在一次接受采访时曾表示,如果她继续留在匈牙利国内,很有可能成为一个充满抱怨的、平庸的科研人员。无路可退的卡里科不得不重新开始找工作。一开始她想在欧洲找个职位,但最终,她只能远赴大西洋彼岸的费城。在那里,美国天普大学(Temple University)为她提供了一个博士后职位。
没有手机、没有信用卡,夫妇两人带着年仅两岁的女儿,踏上了异国他乡。政府不允许兑换超过100美元的现金,他们就在黑市卖掉了车,把900英镑缝在女儿的泰迪熊里偷偷带出境。卡里科说:“我们没有回头路。我们在那里举目无亲。”
1985年,卡里科在美国天普大学(Temple University)重启科研道路。遗憾的是,首站并不顺利。四年后,她与导师发生了一次冲突,主要原因还是两人对待mRNA观念有差异。像当时的许多科研工作者一样,导师也不看好mRNA的研究。1990年,卡里科加入宾夕法尼亚大学。这时,一项最新进展进一步坚定了她开展mRNA应用的决心。
二 也许我不够优秀,不够聪明
1990年,威斯康星大学一个研究小组首次将mRNA注射到小鼠体内(doi: 10.1126/science.1690918),并检测到了相应的蛋白表达;两年后,另一个研究小组进一步在大鼠中证明,体外注入的mRNA表达出的蛋白还具有生理活性。如果这两个结果成立,就意味着采用病原体关键蛋白的mRNA,也会产生病毒蛋白,并激发免疫应答,从而发挥疫苗的作用。
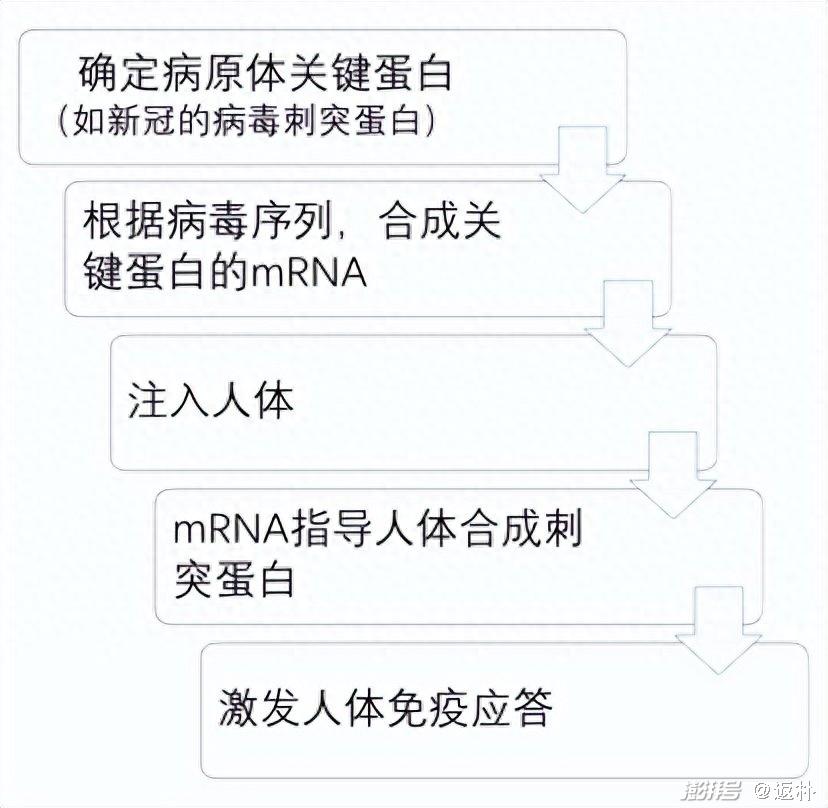
这个逻辑推理很容易获得,但是许多科学家对此并不看好。因为这么做存在诸多现实问题,用mRNA做疫苗至少有三大缺陷:稳定性差(目前这个问题依然存在)、体内效率低下和激发机体先天免疫系统(引起严重炎症反应,导致动物立即死亡)。在许多科学家看来,这些困难都是难以逾越的科学鸿沟,尤其是第三个缺陷,可能最终都难以搞定。这种费力不讨好的事情自然没几个人愿意做,再说传统的疫苗制备策略已足足够用,何必舍近求远?
“主流看法”势必会影响一个领域的发展。许多mRNA研究的大牛都退避三舍,不再提起用mRNA做疫苗这码事,领域内默默无闻的新兵遇到的阻力也就可想而知。
进入宾夕法尼亚大学的当年,卡里科就提交了基金申请,想尝试采用mRNA开发疫苗。在这样的主流背景下,申请失败了。然而没想到,随后几年,年年申请,年年被拒,竟达八年无法为这一课题申请到基金。她回忆说,“我每天晚上都在写基金、写基金、写基金,结果每次都被打回来、打回来、打回来。”你有千条妙计,我有一定之规;任你说得天花乱坠,我就不给你基金。这一今天看来并不怎么“大逆不道”的想法,同行专家就是不予通过。2004年诺贝尔化学奖得主赫什科(Avram Hershko)就认为,专家总是墨守成规,许多观点不值得接受(由于泛素加热后仍保持活性,由此他们认定泛素不可能是蛋白质)。
老板们终于看不下去了。1995年,来到宾大的第六年,卡里科迎来了降级降薪。她回忆到,她当时刚刚做出一些重要的发现,学校把她轰出了实验室,在动物房边上给她安排了一个小房间办公做实验。更惨的是,这个节骨眼,她又被诊断出癌症,需要进行两次手术,而她的丈夫由于签证问题不得不滞留在匈牙利,长达半年无法返美。她只能一边接受治疗,一边照顾孩子。
一般人有此遭遇,早就离开学术界了,但卡里科还是熬了下来:“我想过去别的地方,研究别的东西。我还想过可能是我不够优秀,不够聪明。我努力说服自己:万事已经俱备,我只需要把实验做得更漂亮就行了。”
幸运的是,卡里科最终康复了,并继续开展自己的实验。由于各方限制,做事可谓举步维艰。没经费订杂志,为了看到最新的论文,她还得去复印。在1997年一次复印时,卡里科结识了刚到宾大不久的免疫学家韦斯曼(Drew Weissman)。韦斯曼对卡里科的想法很感兴趣,决定资助她继续开展研究,她的项目也正式成为“韦斯曼-卡里科项目”。卡里科当时的境遇可说降到了冰点,待遇比技术员都要低,韦斯曼的帮助可谓是雪中送炭,不仅仅是资金支持,同样重要的还有精神鼓励。
三 峰回路转,再起波澜
卡里科的研究逐渐有所起色。1998年,期盼已久的基金终于得到批复,尽管只有区区10万美元,但至少是一个好的开始。第二年,又获得100万美元资助。卡里科和韦斯曼商讨后达成一致——需要首先解决mRNA应用的安全性问题,也就是理解mRNA诱发机体炎症反应的原因。
上世纪九十年代,先天免疫机制的阐明拓展了人们对免疫系统的认识。1998年,美国免疫学家巴特勒(Bruce Beutler)发现树突细胞等免疫细胞的表面存在Toll样受体 (TLR) 家族,能识别细菌成分(如脂多糖),两者结合就会激活并启动先天免疫应答,巴特勒也因为这一发现分享2011年诺贝尔生理学或医学奖。
卡里科推测,mRNA注射到动物体内诱发炎症,可能是因为它们可被TLR分子识别。为验证自己假说的正确性,卡里科首先建立一个体外系统模拟炎症反应,应用人工合成的mRNA直接处理细胞,确实激活了免疫应答,释放出大量免疫因子。进一步研究发现,多种TLR分子(包括TLR7,8等)确实可以识别体外注入的mRNA。
2004年,卡里科完成了一个关键实验。她从哺乳动物和细菌中直接提取mRNA,并用它们处理细胞,结果发现哺乳动物mRNA基本不激活免疫应答 (线粒体mRNA除外),而细菌mRNA则诱导细胞因子的释放,这一结果说明,诱发免疫应答的原因不在mRNA本身,而应该在其结构差异。当时已知,哺乳动物mRNA存在广泛的碱基修饰现象,而细菌等原核生物则通常不存在这一现象(与体外合成的mRNA类似)。于是,卡里科对体外合成的mRNA也进行了碱基修饰,结果使免疫应答能力大大减弱(后来动物实验也证明修饰后的mRNA不再产生严重炎症反应)。其实,哺乳动物识别非修饰mRNA(外源物成分),但对修饰mRNA视而不见的能力恰恰是免疫系统的基本特征——区分“非我”,也是机体对自身的保护。这一发现意味着,mRNA体内应用的安全性得到了有效解决(通过体外碱基修饰来实现)。
卡里科进一步研究还发现,体外合成的mRNA通常会污染一定量的双链RNA,而双链RNA也会引发免疫应答,因此她对最初合成的RNA进行纯化,除去双链RNA。这种操作一方面减少了炎症发生,更重要的是极大增加了mRNA在体内的蛋白生成效率,从而解决mRNA应用过程中效率低下的难题。卡里科共发表70多篇论文,绝大多数聚焦于mRNA体外制备方法的改进和完善,解决实际应用过程中面临的诸多问题。
2006年,卡里科和韦斯曼申请了第一个mRNA相关专利——含修饰核苷酸的mRNA制备及应用,主要涉及无免疫原性、包含核苷酸修饰等特性的mRNA(专利号:US 8278036)。迄今为止,她已拥有十几个专利,全部围绕着mRNA制备方法的改进、实用化操作和应用。当年,她与人和合作共同成立了一家生物技术公司——RNARx,尝试开发mRNA药物(主要开发治疗贫血的EPO mRNA),但公司最终于7年后关闭。卡里科期望的mRNA应用热潮并未出现,市场对这项研究并不热衷,因此也少人问津。
2010年,转机再次出现。正在斯坦福大学做博士后的罗西(Derrick Rossi)发现了卡里科的文章,并敏锐意识到这一方法的巨大应用潜力。他成立了一家生物技术公司——也就是Moderna,应用mRNA开发疫苗和药物。与此同时,卡里科也将自己的技术转让给德国一家新兴生物技术公司BioNTech。彼时,BioNTech还蜗居在德国美因茨大学(Mainz university)的校园内,连公司网站都没做起来。
2013年,卡里科与宾夕法尼亚大学又发生一次不愉快,校方拒绝恢复她1995年降薪的教师职位,又在知识产权许可上与她产生分歧(宾大将知识产权卖给了另一家公司)。最终,卡里科选择辞职,加入BioNTech并担任高级副总裁。校方对卡里科极尽刻薄,称BioNTech是一家连网站都不存在、名不见经传的小公司,暗示卡里科的选择毫无价值。
随着mRNA技术在应用过程中的进一步改进,两家公司距离真正的市场成功越来越近。2017年,Moderna开始开发寨卡病毒mRNA疫苗;2018年,BioNTech与辉瑞公司合作开发流感mRNA疫苗,尝试从实验室走向应用。但市场仍不买账,投资者对mRNA疫苗应用前景并不看好,两家公司只能 “艰难度日”。
在这沉默苦闷的研究岁月中,比卡里科出名更早的是她的女儿祖萨娜·弗朗西亚(Zsuzsanna Francia)。也许是继承了母亲坚忍不拔的精神,祖萨娜在2008年北京奥运会和2012年伦敦奥运会上连续夺得了划船比赛冠军。

2012年伦敦奥运会,卡里科夫妇祝贺女儿夺取奥运金牌。Katalin Kariko供图
四 完美救赎
2020年初,新冠肺炎暴发,新冠病毒蔓延全球。
1月11日,中国疾控中心张永振研究团队在病毒学网站(virological.org)公布了新型冠状病毒全基因组序列。
序列刚刚公开,欧美的制药公司就开始研究mRNA疫苗将要使用的序列。
1月13日,序列确定,Moderna开始制作mRNA。
后来的事情,我们都知道了。
在全球多国参与的新冠疫苗开发竞赛中,mRNA疫苗的优势(研发时间短)充分体现,在得到新冠病毒刺突蛋白(S)mRNA信息基础上,快速开启设计、制备、动物实验、临床实验等步骤。11月9日,辉瑞与BioNTech联合宣布,基于Ⅲ期临床结果,其研发的新冠疫苗mRNA BNT162b2有效率超过90%(最终数据显示有效率可达95%);一周后,Moderna宣布,其开发的mRNA疫苗mRNA-1273有效率也接近95%。
当卡里科听到BioNTech三期临床振奋人心的结果后,她的第一反应是:“得救了!我拼命地吸气,我太兴奋了,我真怕我死了……”悬了许久的心终于可以得到些许休息。卡里科希望mRNA疫苗能在随后新冠肺炎预防方面发挥重要作用,并期望mRNA技术能在更多疾病治疗方面得到广泛应用。
现在已经是哈佛大学干细胞研究所教授的罗西认为,如果mRNA疫苗最终在新冠肺炎疫情方面发挥了关键性作用,卡里科和韦斯曼绝对配得上诺贝尔化学奖。
此时距卡里科最初开始研究mRNA已有四十多年,距离她的关键技术突破也有了十五年。
主要参考文献
1. Karikó K, Buckstein M, Ni H,et al. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity. 2005,23(2):165-175.
2. Karikó K, Muramatsu H, Ludwig J, et al. Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA. Nucleic Acids Res, 2011,39(21):e142.
3. Sahin U, Karikó K, Türeci Ö. mRNA-based therapeutics--developing a new class of drugs. Nat Rev Drug Discov. 2014,13(10):759-780.
4. Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines - a new era in vaccinology.Nat Rev Drug Discov. 2018,17(4):261-279.
5. Wolff JA, Malone RW, Williams P, et al. Direct gene transfer into mouse muscle in vivo. Science. 1990, 247: (4949 Pt 1)1465–1468.
6. Jirikowski GF, Sanna PP, Maciejewski-Lenoir D, et al. Reversal of diabetes insipidus in Brattleboro rats: intrahypothalamic injection of vasopressin mRNA. Science. 1992, 255 (5047): 996–998.
7. COX D. How mRNA went from a scientific backwater to a pandemic crusher.( https://www.wired.co.uk/article/ ... ine-pfizer-biontech)
8. A TYPICAL HUNGARIAN STORY: KATALIN KARIKÓ (https://hungarianspectrum.org/20 ... ory-katalin-kariko/)
9. BioNTech scientist Katalin Karikó risked her career to develop mRNA vaccines. Americans will start getting her coronavirus shot on Monday.
(https://www.businessinsider.com/ ... coronavirus-2020-12)
10. The story of mRNA: How a once-dismissed idea became a leading technology in the Covid vaccine race(https://www.statnews.com/2020/11 ... covid-vaccine-race/)
11. 'Redemption': How a scientist's unwavering belief in mRNA gave the world a Covid-19 vaccine
(https://www.telegraph.co.uk/glob ... ef-mrna-gave-world/)
引自-https://www.thepaper.cn/newsDetail_forward_24818820
 扫码加好友,拉您进群
扫码加好友,拉您进群



 收藏
收藏