一提到“凝胶”,你可能会联想到护肤品中的保湿成分,或是实验室中脆弱的水凝胶——质地柔软、容易断裂,似乎与“坚固”毫无关联。然而,发表在《Science Advances》上的一项研究彻底改变了这一固有印象:来自香港大学与香港城市大学的研究团队开发出一种高强度抗断裂离子凝胶(HSFRI),不仅能够承载高达2.5kg的重量(相当于自身重量的5000倍),还具备作为“智能创可贴”促进伤口愈合的能力,并可用于可穿戴设备中监测心电图和脑电图。

一、“硬实力”突破:打破传统凝胶的力学局限
长期以来,离子凝胶被视为柔性电子和生物医学领域的潜力材料,因其具备离子导电性且能在极端环境下保持稳定。但“高强度”与“抗断裂”往往难以兼得,成为制约其应用的关键瓶颈。
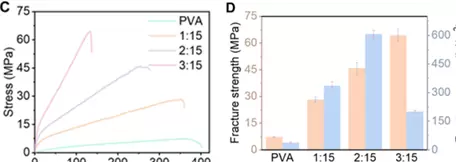
研究人员指出:“多数现有离子凝胶的断裂强度低于1MPa,断裂能不足1kJ/m,稍受外力即发生破裂,难以满足实际使用需求。”而新型HSFRI凝胶则显著提升了这两项核心性能指标:
- 断裂强度达到64.5MPa,是传统水凝胶的12.6倍;
- 断裂能达到约607kJ/m,为传统水凝胶的54.4倍。
实验图像直观展示了这种差异:在悬挂2.5kg重物时,传统水凝胶迅速断裂,而HSFRI仍能稳固支撑。

更值得一提的是,该凝胶的力学性能具有可调性。通过调节硬相材料芳纶纳米纤维(ANF)与软相材料聚乙烯醇(PVA)的比例,可以灵活控制其强度与柔韧性。例如,当ANF与PVA的质量比为3:15时,凝胶的断裂强度达到峰值,同时仍保有良好的折叠与扭转能力。
二、技术核心:减少溶剂干扰,增强内部协同作用
HSFRI为何如此强韧?关键在于其独特的“溶剂定制”策略。
传统水凝胶的问题源于“溶剂竞争”——水分子会与聚合物链争夺氢键结合位点,削弱ANF(硬相)与PVA(软相)之间的连接,导致结构松散、易断裂。
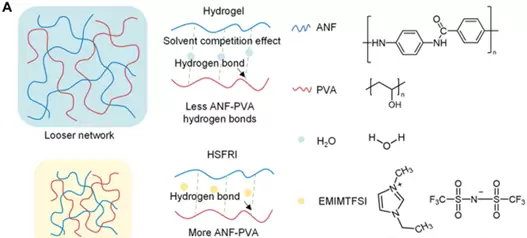
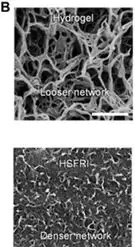
研究团队另辟蹊径,采用EMIMTFSI离子液体替代水作为溶剂。这种离子液体形成氢键的能力较弱,不会干扰ANF与PVA间的相互作用,反而促使二者之间形成大量氢键,如同无数“隐形粘扣”,构建出致密且高度连通的纳米纤维网络。
分子动力学模拟结果证实:在HSFRI中,ANF与PVA之间的氢键数量是传统水凝胶的3倍。此外,EMIMTFSI还能通过静电作用和π-π堆积进一步增强材料间的结合力,在确保结构稳定性的同时保留足够的液态组分,使凝胶兼具刚性与柔韧。
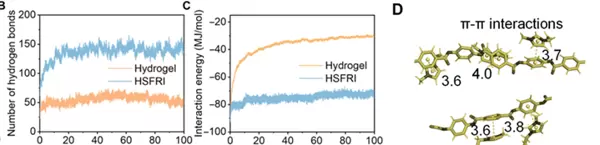
简而言之,通过“降低溶剂对内部结构的干扰”,实现了凝胶内部各组分的高度协同,从而达成“高强”与“耐断”的双重目标。
三、多功能集成:不止于承重,更是多场景应用的潜力材料
若仅以力学性能见长,HSFRI尚不足以令人惊叹。真正使其脱颖而出的是其集“优异力学表现+良好生物相容性+多样化功能”于一体的综合特性,展现出广阔的应用前景。
1. 可穿戴生物电子设备:解决干燥与透气难题
当前可穿戴设备面临两大挑战:“易失水干燥”和“佩戴不透气”。HSFRI恰好提供了有效解决方案:
- 抗干燥性强:由于所用离子液体挥发性极低,HSFRI在空气中暴露一周后质量几乎无变化;相比之下,传统水凝胶在24小时内水分流失达82.1%,迅速变脆失效。
- 透气性能优越:其水蒸气透过率高达472g·m·day,是常用PDMS薄膜的15倍,贴附皮肤时不易积汗,长时间佩戴依然舒适。

基于这些优势,研究团队将HSFRI用于制备可穿戴电极——通过在其内部原位聚合聚吡咯(PPy),获得高精度生物传感器。实验证明,该电极可稳定采集心电图(ECG)、肌电图(EMG)和脑电图(EEG),信噪比与商用标准电极相当。
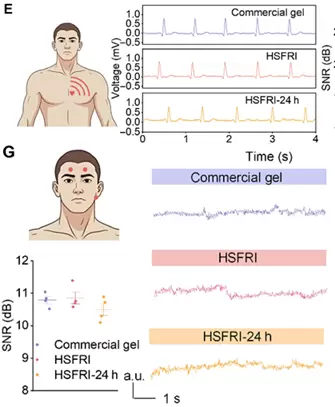
例如,在记录脑电波时,它能清晰识别代表“放松状态”的α波,即便在空气中暴露24小时,信号依旧稳定可靠。
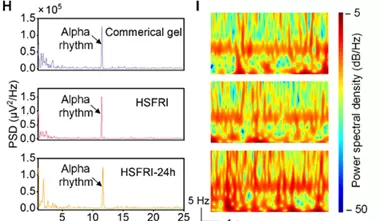
未来,这项技术有望应用于智能手环、脑机接口等设备,有效缓解“佩戴时间长后失效”或“皮肤闷热不适”等问题。
2. 智能创可贴:助力慢性伤口修复
慢性伤口愈合困难一直是临床难题,而HSFRI的多重特性正好契合理想敷料的需求:
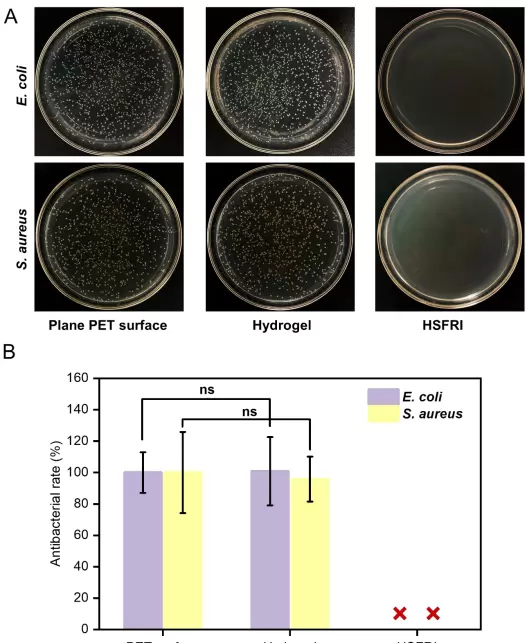
- 高效抗菌:EMIMTFSI中的阳离子及疏水链可破坏细菌细胞膜,对大肠杆菌和金黄色葡萄球菌的抑菌率均达100%,显著优于传统水凝胶,有助于预防感染。
- 药物负载能力强:可溶解红霉素等疏水性药物,实现局部精准释放,避免全身用药带来的副作用。
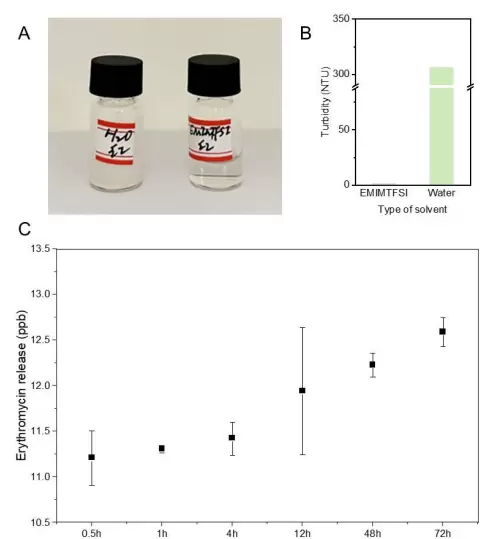
- 支持电刺激治疗:其离子导电性为6.5mS/m,处于人体皮肤生理导电范围内,配合微电流刺激可促进细胞增殖与组织再生,加速伤口修复进程。
四、不止于凝胶:一种可复制的“材料设计思路”
这项研究的意义并不仅限于开发出一种新型高性能离子凝胶。更重要的是,它提出了一种具有广泛适用性的材料设计策略——通过精确调控溶剂与溶质之间的相互作用,增强复合材料内部界面的结合力,从而有效突破传统软材料在力学性能上的瓶颈。
研究团队进一步验证了该策略的普适性:即便将硬相材料替换为纤维素或丝素蛋白,软相材料替换为壳聚糖,只要采用相同的溶剂定制方法,依然能够制备出具备高强度和优异断裂抵抗能力的离子凝胶。这表明,这一设计思路具备高度的可迁移性,有望成为未来多种功能性软材料开发的通用范式。

基于这种理念,未来有望拓展至柔性机器人、组织工程支架、可穿戴设备以及能源存储系统等多个前沿领域,推动新一代“强韧兼具”的智能软材料的发展。
正如研究人员在讨论中所强调:“这项工作不仅拓展了离子凝胶的实际应用范围,也为下一代高性能软材料的设计提供了全新的路径。”
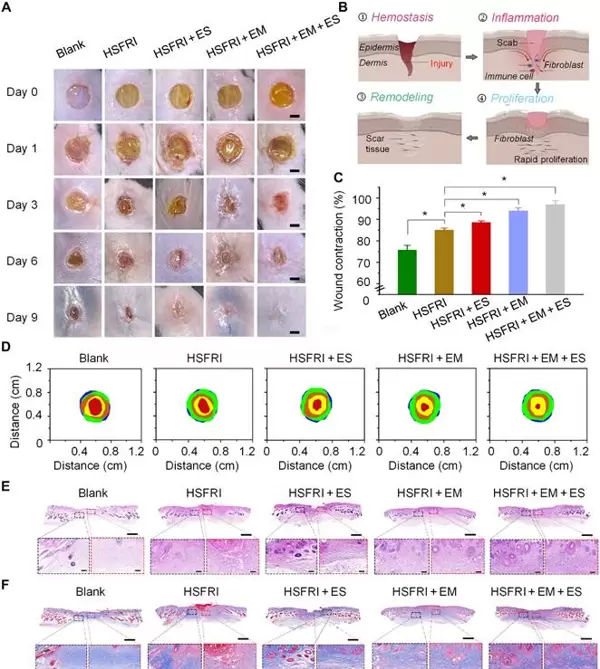
团队还在大鼠感染伤口模型中对该材料组合进行了验证。结果显示,采用“HSFRI + 红霉素 + 电刺激”协同治疗的伤口,在9天内的收缩率达到96.84%,显著高于空白对照组的75.74%。组织切片分析进一步证实,治疗组伤口区域出现了更多的毛囊与皮脂腺再生,胶原蛋白沉积也更为密集——说明该方案显著加速了组织修复进程,相当于为伤口愈合按下了“快进键”。

 扫码加好友,拉您进群
扫码加好友,拉您进群