MYB家族是一类广泛存在且高度保守的转录因子(TFs),在植物中尤为丰富,构成了最大的转录因子家族之一。尽管最初在动物中被发现并以禽成髓细胞瘤病毒蛋白(v-Myb)命名,但其在植物中的功能更为多样和关键。大量研究表明,MYB蛋白参与调控多种植物特异性过程,如初级与次级代谢、细胞分裂与分化、发育调控、激素响应以及对生物和非生物胁迫的适应,因而被视为普遍存在的调控因子。
2025年,四川大学林宏辉、张大伟与周华鹏团队在《Journal of Integrative Plant Biology》发表综述文章,系统梳理了MYB转录因子的分子调控机制,为深入理解其生物学功能及在作物遗传改良中的应用提供了重要理论依据。

MYB基因家族的分类
通过全基因组鉴定分析,MYB基因家族已被证实广泛分布于多种模式植物和重要农作物中(图1A)。该家族成员的显著特征是其N端具有高度保守的DNA结合域(DBD),即MYB结构域。这一结构域不仅介导DNA识别,还参与蛋白质间的相互作用,通常由一至四个不完全重复序列(R)构成。每个重复单元约含52个氨基酸残基,折叠形成三个α-螺旋结构,其中第二和第三螺旋组成典型的螺旋-转角-螺旋(HTH)构型,并依靠三个均匀分布的色氨酸残基维持疏水核心的稳定性。
根据重复序列的数量,MYB蛋白可分为四类(图1B):
- 2R-MYB(R2R3):数量最多、功能最广泛的亚群,主要识别AC顺式作用元件,参与生长发育与逆境响应的调控;
- 1R-MYB:第二大类,能结合端粒序列TTAGGG,在细胞形态建成与代谢调控中发挥作用;
- 3R-MYB(R1R2R3):进化上较为保守,成员较少;
- 4R-MYB:最为稀少的一类,仅在少数物种中有报道,功能尚待进一步解析。
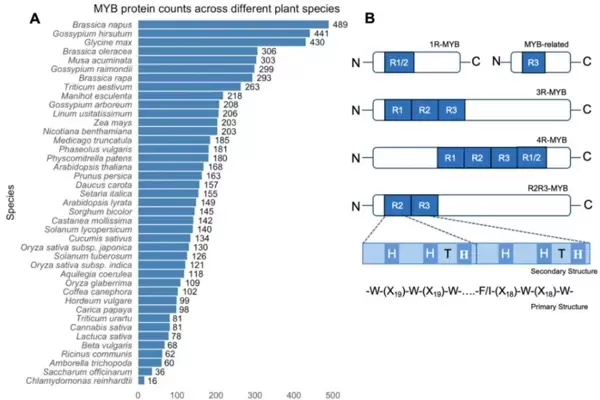
图1. MYB转录因子的分布与结构特征
MYB转录因子在植物代谢与发育中的调控功能
随着多个植物基因组的测序完成,大量MYB家族成员被鉴定出来。其庞大的家族规模和结构保守性提示其在植物生命活动中具有核心地位。众多研究已证实,MYB转录因子深度参与次生代谢调控、细胞命运决定、器官发生以及生殖发育等多个关键过程。
1)苯丙烷类代谢的调控
苯丙烷类化合物是天然产物中种类最丰富的类别之一,包括黄酮、花青素、单木质醇和单宁等,广泛参与光合作用、营养吸收、氧化还原平衡维持以及对环境胁迫的响应。R2R3-MYB转录因子被公认为调控这些化合物生物合成的关键开关,通过直接或间接调控结构基因的表达,影响代谢通路的流向与强度(图2)。
R2R3-MYB的主要调控模式如下:
- 花青素合成:
- 早期基因(EBGs)受R2R3-MYB直接激活;
- 晚期基因(LBGs)依赖MYB-bHLH-WD40(MBW)复合物协同调控;
- 激活因子示例:AtMYB75/PAP1(拟南芥)、MYBA/MYB10(蔷薇科);
- 抑制因子示例:含有C1/C2结构域的MYB蛋白,如AtMYB4、AtMYB32。
- 黄酮类合成:
- MYB11/12/111可形成MBW复合物,激活CHS等关键酶基因;
- 抑制型MYB(如AtMYB4、AtMYB7、AtMYB32)则干扰复合物组装,抑制通路活性。
- 木质素合成:
- 激活因子如AtMYB46、AtMYB83通过结合AC元件促进木质素合成相关基因表达;
- 抑制因子如AtMYB75、PvMYB4可通过竞争结合位点降低木质素积累。
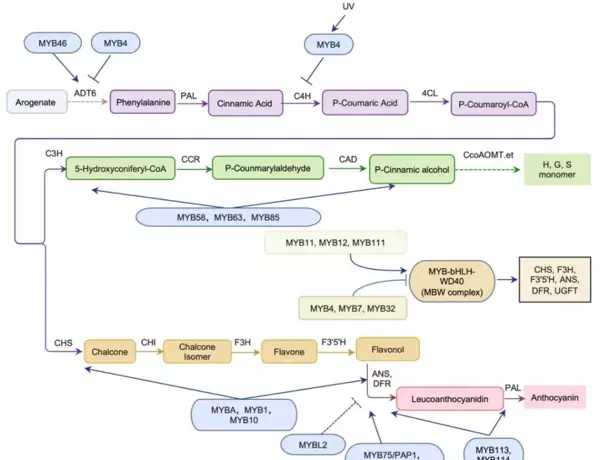
图2. MYB转录因子在苯丙烷类代谢多层级上的调控网络
2)细胞周期调控
3R-MYB亚家族在有丝分裂进程中发挥核心作用。其中,MYB3R1和MYB3R4作为激活型因子(Act-MYB),促进G2/M期相关基因的表达,推动细胞进入分裂阶段;而MYB3R3和MYB3R5则作为抑制型因子(Rep-MYB),通过与DREAM复合物结合,靶向E2F和MSA元件,抑制G1/S和G2/M转换,维持细胞静止状态。当DNA受损时,CDK抑制因子被激活,导致Act-MYB失活,同时Rep-MYB稳定性增强,从而引发细胞周期阻滞。值得注意的是,MYB3R1具备双重调控能力,可在不同阶段协调激活与抑制功能,实现精准时空调控。此外,部分R2R3-MYB(如AtMYB46)也被发现参与细胞周期与细胞壁合成基因的共调控,而FLP/MYB88则通过抑制CDKB1表达,限制气孔保卫细胞的过度增殖。
3)组织发育调控
MYB转录因子在植物多种组织和器官的发育过程中扮演关键角色。例如,在根部发育中,特定MYB成员参与根毛形成与侧根起始;在叶片与表皮发育中,调控表皮毛的起始与分支模式;在维管系统发育中,MYB46和MYB83作为主控因子驱动次生细胞壁的沉积。此外,在生殖发育过程中,某些MYB蛋白还参与花器官决定、配子体发育及种子成熟等环节,显示出其功能的多样性与复杂性。
在植物根部发育过程中,表皮细胞会分化为两种主要类型:根毛细胞与非根毛细胞。这种细胞命运的决定依赖于其与皮层细胞之间的接触模式,并受到精细的分子调控机制控制,对植物吸收水分和养分具有重要意义。当一个表皮细胞同时接触两个皮层细胞时,移动性蛋白CPC被激活,抑制WER-GL3/EGL3-TTG1复合物对下游基因GL2的启动,从而促使该细胞向根毛细胞方向分化;而仅接触一个皮层细胞的表皮细胞则能形成完整的MBW复合物(即MYB-bHLH-WD40),激活GL2表达,最终发育为非根毛细胞(图3)。这一调控模型不仅适用于根毛分化,在表皮毛的发育中也广泛存在。例如,在拟南芥中,AtGL1、AtMYB23等R2R3-MYB转录因子协同调控表皮毛的起始、分支形态以及种皮结构的建成,其中AtMYB5在整体调控网络中占据主导地位。在棉花中,GhMYB25和GhMYB109参与纤维的初始发生与伸长过程,而GhMYBML10和GhMML4则分别影响花瓣尖端纤维的生成及棉绒产量的高低。
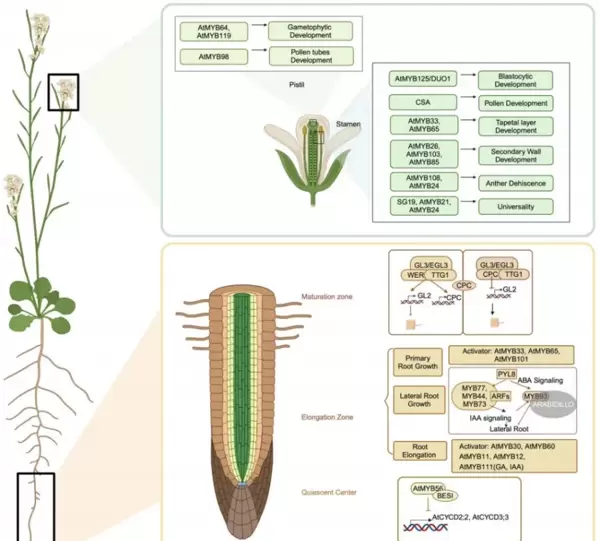
图3. MYB?TFs调控植物生长和发育
MYB转录因子在植物器官发育过程中展现出时空特异性的表达模式,贯穿整个生命周期(图3)。在幼苗阶段,DRMY1参与叶原基和根尖分生组织的建立;进入生殖期后,RAX1-3等因子整合CUC、生长素与KNOX信号通路,调控侧生器官的发生及花和种子的形成。在根系发育方面,AtMYB56、3R1和3R4参与维持根尖分生区的细胞周期动态;AtMYB30与AtMYB60促进伸长区细胞的扩展;AtMYB36则驱动成熟区内皮层的特化。此外,MYB70、MYB93和MYB96通过整合ABA、IAA与ROS信号路径,精细调节主根与侧根的发育平衡;而AtMYB88/124和AtMYB20则介导向重力响应及多种环境胁迫适应。
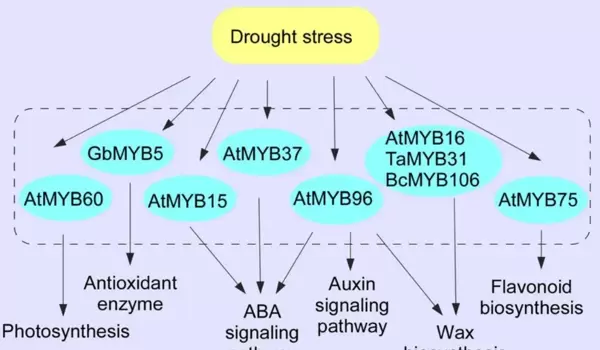
图4. MYB TFs调控植物对干旱的响应和抗性
面对干旱胁迫,MYB类转录因子通过多维度机制提升植物耐旱能力(图4)。它们可整合ABA信号通路,调控气孔关闭以减少水分流失,如AtMYB15、AtMYB37和AtMYB96均能增强ABA敏感性并诱导气孔闭合;AtMYB60则负向调控保卫细胞开度,在维持CO吸收的同时协调水分利用效率。部分成员如AtMYB16、AtMYB106和TaMYB31可促进表皮蜡质沉积,增强角质层屏障功能;AtMYB75和GbMYB5分别通过提高抗氧化性黄酮类物质或渗透保护剂脯氨酸的积累来缓解脱水损伤。同时,AtMYB96还连接ABA与生长素信号,优化根系构型,促进水分吸收。
在盐胁迫条件下,MYB转录因子通过多层次机制维持离子稳态、减轻氧化损伤并增强细胞保护能力(图5)。SIZ1介导的SUMO化修饰可激活AtMYB30,进而上调AOXla表达以维持线粒体氧化还原平衡;AtMYB37有助于维持光合系统完整性并缓解膜脂过氧化;AtMYB49参与角质层构建并增强抗氧化酶活性;AtUBC1/2通过介导组蛋白H2B单泛素化,激活AtMYB42-MPK4-SOS2信号轴;AtMY44则依赖H2A.Z核小体的移除实现自我正反馈激活;RdDM通路可启动AtMYB74的表达;GmCaM4-AtMYB2复合体通过促进脯氨酸合成发挥作用,而AtMYB20则通过抑制ABA信号中的负调控因子增强耐盐性;MdMYB108L、TaMYB73和LcMYB1则分别通过清除ROS、稳定离子平衡或增加渗透调节物质含量来提升抗逆性能。
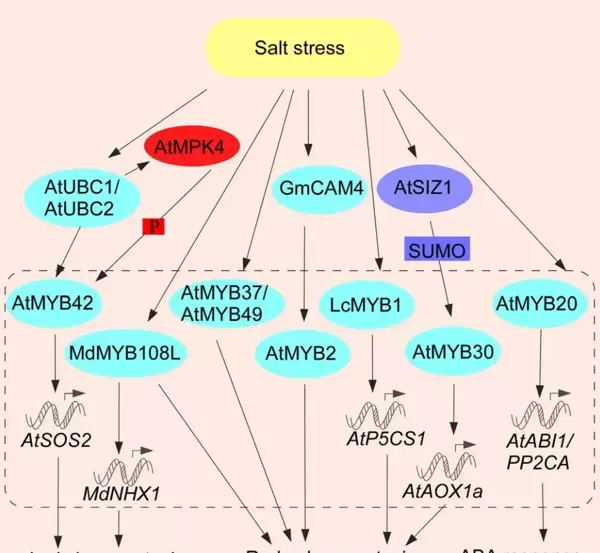
图5. MYB TFs调控植物对盐胁迫的响应和抗性
温度胁迫包括低温与高温,MYB家族成员通过调控CBF通路及相关代谢网络应对冷热变化(图6)。在冷胁迫下,部分MYB因子如AtMYB15和AtMYB43对CBF基因起负调控作用,限制过度应答;而AtMYB14、MdMYB23以及MdMYB88/124则通过激活CBFs表达、促进原花青素积累和增强抗氧化系统来提高耐寒性;水稻中OsMYBS3与OsDREB1共同构成互补的低温响应调控网络。在热胁迫环境中,MYB30通过钙信号通路参与耐热性调控,OsMYB55则通过调节氨基酸代谢相关基因的表达帮助植株适应高温条件。
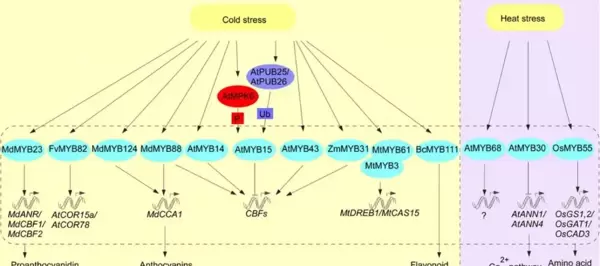
图6. MYB TFs调控植物对温度(热/冷)胁迫的响应和抗性
UV-B辐射虽处于太阳光谱边缘,但其强度增加会对植物造成严重伤害,包括抑制光合作用、破坏DNA与蛋白质结构并引发氧化应激。为此,植物进化出以酚类化合物为核心的化学防护系统,尤其是黄酮类和羟基肉桂酸衍生物的积累,有效吸收有害辐射。这一过程由MYB转录因子精密掌控。在拟南芥中,AtMYB4通过抑制C4H和AtMYB7的表达,降低羟基肉桂酸的合成水平,其突变体反而表现出更强的UV耐受能力;UV-B可诱导MYB13表达,促进黄酮类物质积累;PFG/MYBs亚族(包括MYB11、MYB12、MYB111)是黄酮醇生物合成的关键激活子,在胁迫条件下被油菜素内酯信号核心蛋白BES1抑制,促使植物资源从生长转向防御反应。在荞麦中,FtMYB4R1可直接结合CHS等结构基因的启动子区域,调控黄酮与花青素的合成路径。
对于淹水与缺氧胁迫,尽管原文未展开详细描述,但已知MYB转录因子在低氧环境下亦发挥重要调控作用,涉及能量代谢重编程、无氧呼吸途径激活及根系通气组织形成等多个方面,未来仍需进一步解析其具体机制。
植物在面对淹水胁迫时,根系呼吸受到抑制,同时深层水中光照不足,严重影响其正常生长。在此过程中,MYB转录因子扮演着关键的调控角色。例如,水稻中的OsMybleu以及拟南芥中的AtMYB2能够识别并结合厌氧诱导基因上的MYB顺式作用元件,从而激活缺氧应答机制;而AtMYB30则通过下调乙烯合成途径中的限速酶ACS7的表达,减少乙烯积累,并在退水阶段整合光信号与茉莉酸通路,促进维生素C和谷胱甘肽的合成,增强植株的抗氧化能力。
在生物胁迫响应方面,植物主要依赖模式触发免疫(PTI)和效应子触发免疫(ETI)来抵御病原体侵染,前者由位于细胞膜表面的模式识别受体(PRRs)启动,后者则由细胞内的NOD样受体(NLRs)介导。近年来的研究不断揭示,MYB转录因子是植物免疫反应的核心调控节点,通过多种机制实现广谱抗性(图7)。具体而言,MYB15促进木质素沉积,强化细胞壁结构;MYB28调控硫代葡萄糖苷的生物合成以抵抗真菌侵害;MYB30、OsMYB30/55/110及BnMYB43参与调控程序性细胞死亡、酚类物质代谢以及生长与防御之间的资源分配;MYB72、MYB73和MYB96则整合茉莉酸(JA)、乙烯(ET)和水杨酸(SA)信号通路,激活系统性抗性和基础免疫反应;此外,MYB59和MYB83参与线虫抗性的调控,而MYB75通过调控黄酮类化合物的积累,在应对广食性和专食性昆虫取食中发挥平衡作用。
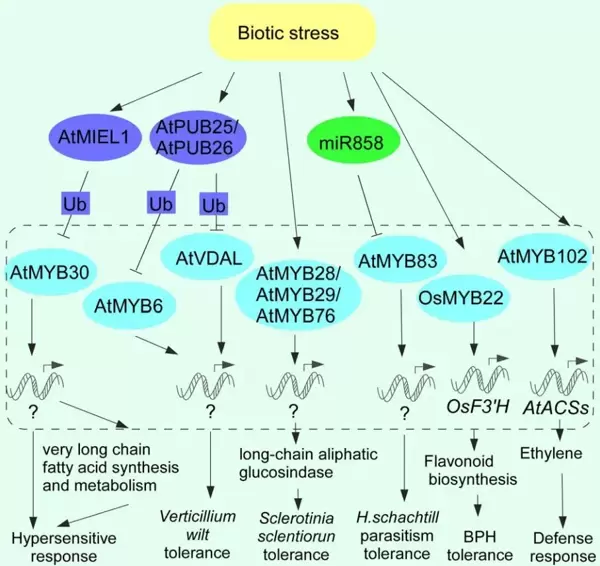
结语
本综述系统梳理了MYB转录因子在植物发育过程及逆境适应中的多样化功能及其分子调控机制。研究证实,MYB转录因子作为重要的信号整合中心,能够精确协调植物对外界环境变化和内部激素信号的响应,进而调控代谢重编程与胁迫耐受性。未来的研究可进一步挖掘尚未明确功能的MYB亚家族成员,深入解析特定MYB转录因子的作用网络,并探索其在作物遗传改良中的应用潜力,为培育高产、抗逆的新品种提供理论支持和技术路径。

 扫码加好友,拉您进群
扫码加好友,拉您进群