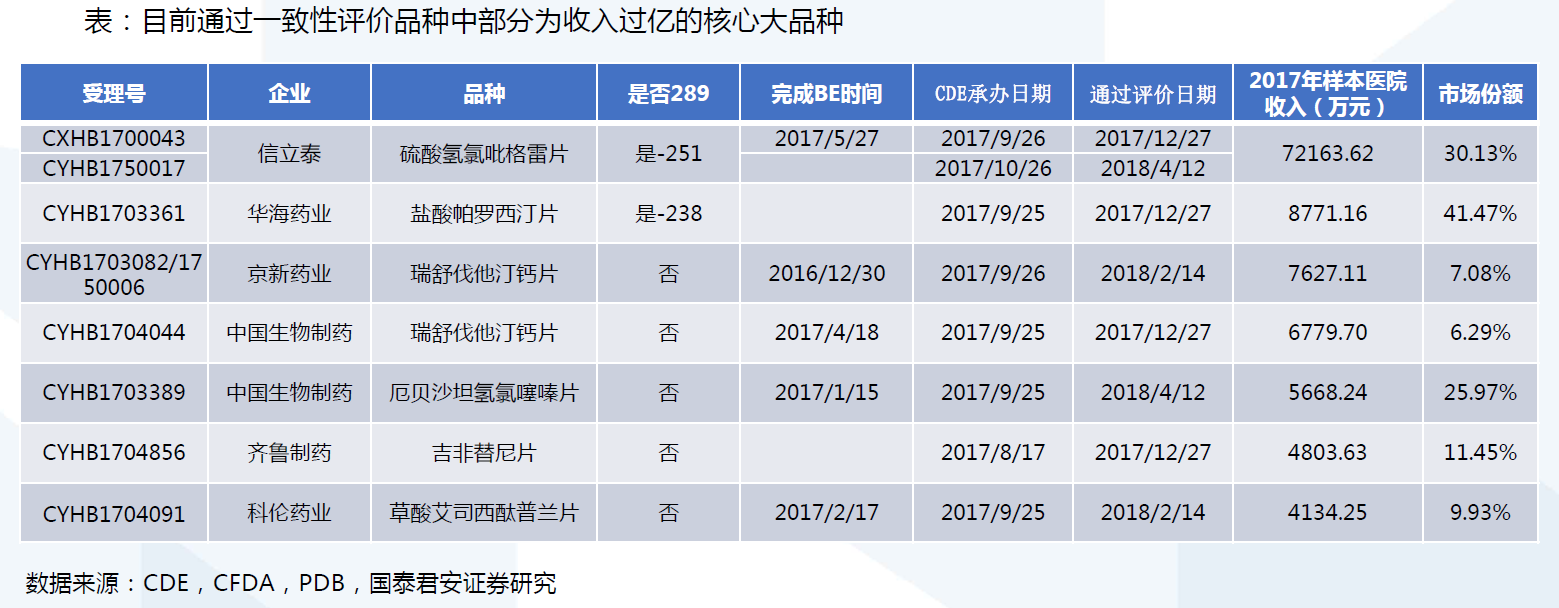
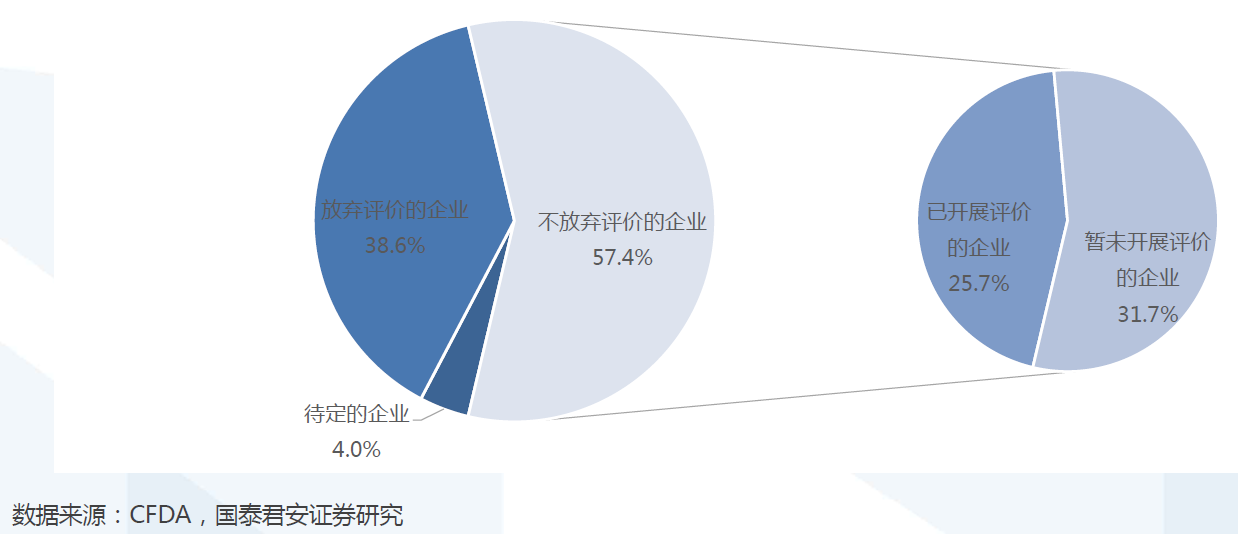
评价范围:涉及11.6万批文,2018年底前完成17740批文。约涉及11.6万个批文的仿制药。根据国家政策要求,化学药品新注册分类实施(2016年3月4日)前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。
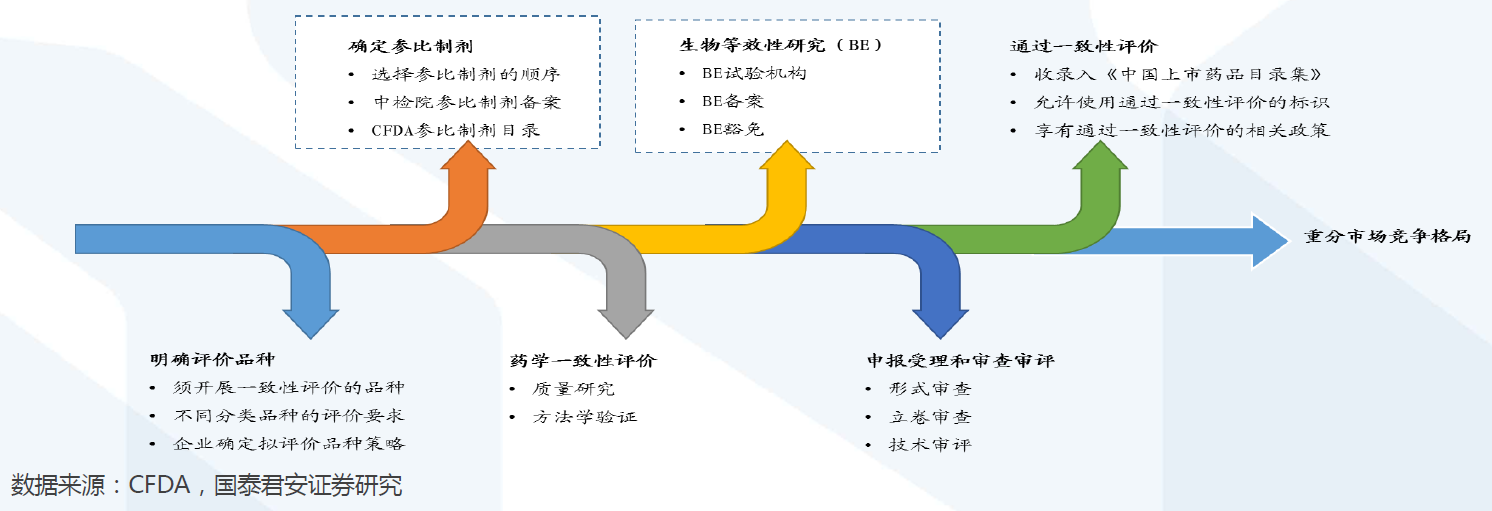
 评价流程:确定参比制剂与开展BE试验是两大关键。
评价流程:确定参比制剂与开展BE试验是两大关键。开展仿制药质量和疗效一致性评价工作,要求已经批准上市的仿制药品, 在质量和疗效上与原研药品能够一致,临床上与原研药品可以相互替代。
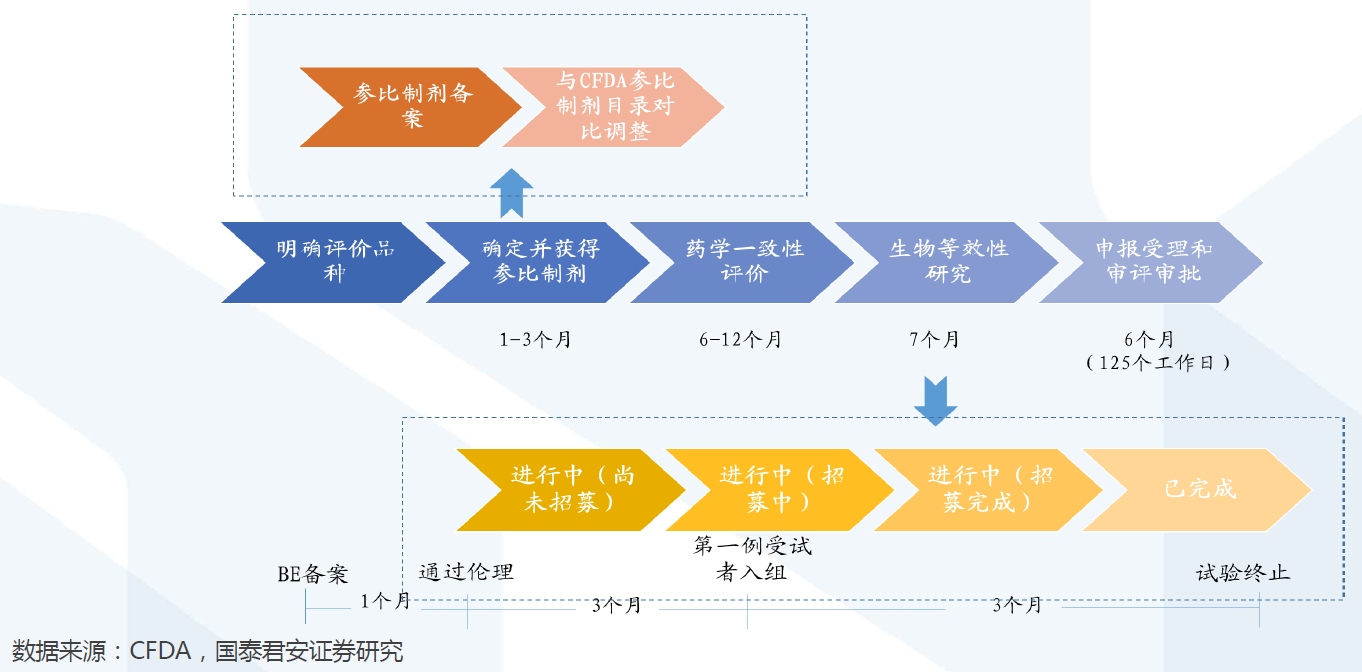
 评价时间: 单个品种通过一致性评价周期约为20-28个月。
评价时间: 单个品种通过一致性评价周期约为20-28个月。单个品种通过一致性评价的周期约为20-28个月,其中:①确定并获得参比制剂需1-3个月;②开展药学一致性评价需6-12个月;③开展BE试验需7 月左右(从BE备案至试验终止);④申报受理和审评审批需6个月左右。

【免费下载】
http://tinyurl.com/y7jnj3eu
【备用下载】

 扫码加好友,拉您进群
扫码加好友,拉您进群